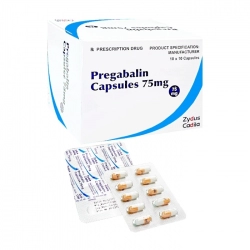
Pegstim 6mg/6ml Zydus 1 ống
* Hình sản phẩm có thể thay đổi theo thời gian
** Giá sản phẩm có thể thay đổi tuỳ thời điểm
30 ngày trả hàng Xem thêm

Tìm thuốc Pegfilgrastim khác
Tìm thuốc cùng thương hiệu Zydus Cadila khác
Thuốc này được bán theo đơn của bác sĩ
Gửi đơn thuốc.svg)
Bạn muốn nhận hàng trước 4h hôm nay. Đặt hàng trong 55p tới và chọn giao hàng 2H ở bước thanh toán. Xem chi tiết
Chỉ dành cho mục đích thông tin. Tham khảo ý kiến bác sĩ trước khi dùng bất kỳ loại thuốc nào.
Thông tin sản phẩm
| Hoạt chất: | |
| Quy cách đóng gói: | |
| Thương hiệu: | |
| Xuất xứ: | |
| Thuốc cần kê toa: | |
| Dạng bào chế: | |
| Hàm Lượng: | |
| Nhà sản xuất: |
Nội dung sản phẩm
Thành phần
- Pegfilgrastim: 6mg.
Công dụng (Chỉ định)
- Thuốc làm rút ngắn thời gian giảm bạch cầu đa nhân trung tính, làm giảm tỷ lệ sốt giảm bạch cầu đa nhân trung tính và làm giảm tỷ lệ nhiễm trùng biểu hiện bởi giảm bạch cầu đa nhân trung tính có sốt ở bệnh nhân điều trị với hóa trị độc tế bào cho bệnh ác tính (ngoại trừ bạch cầu mạn dòng tủy và các hội chứng bất sản tủy).
Liều dùng
- Người lớn (trên 18 tuổi): Một liều Pegfilgrastim 6mg (một bơm tiêm đóng sẵn duy nhất) được khuyến cáo cho mỗi chu kỳ hóa trị, đưa thuốc vào bằng cách tiêm dưới da khoảng 24 giờ sau hóa trị độc tế bào.
- Việc điều trị Pegfilgrastim nên được bắt đầu và theo dõi bởi các bác sĩ có kinh nghiệm trong ung thư và/hoặc huyết học.
Cách dùng
Dùng tiêm dưới da.
Hướng dẫn sử dụng, thao tác:
- Bơm tiêm đóng sẵn Pegfilgrastim chỉ cho sử dụng một lần duy nhất.
- Pegfilgrastim là dung dịch vô khuẩn nhưng không có chất bảo quản.
- Trước khi tiêm, nên quan sát dung dịch Pegfilgrastim xem có các mảnh cặn. Chỉ được tiêm dung dịch trong và không màu.
- Lắc mạnh có thể gây kết tụ pegfilgrastim, làm cho thuốc không hoạt tính về mặt sinh học.
- Cho phép bơm tiêm đóng sẵn đạt được nhiệt độ phòng trước khi tiêm.
Quá liều
- Không nhận thấy tác dụng ngoại ý nghiêm trọng nào xảy ra ở số ít người tình nguyện khỏe mạnh và bệnh nhân ung thư phổi không phải tế bào nhỏ khi tiêm dưới da liều duy nhất 300mcg/kg.
- Các tác dụng không mong muốn cũng tương tự như ở những bệnh nhân dùng pegfilgrastim liều thấp hơn.
Không sử dụng trong trường hợp sau (Chống chỉ định)
- Quá mẫn với pegfilgrastim, filgrastim, các protein có nguồn gốc E. coli, hoặc với bất kỳ tá dược nào.
Tác dụng không mong muốn (Tác dụng phụ)
Thử nghiệm lâm sàng:
Trong các nghiên cứu lâm sàng ngẫu nhiên trên những bệnh nhân có bệnh ác tính đang dùng Pegfilgrastim sau khi hóa trị độc tế bào, hầu hết các tác dụng ngoại ý gây ra do bệnh ác tính đi kèm hoặc hóa trị độc tế bào.
Tác động không mong muốn thường xuyên nhất được ghi nhận và có liên quan đến thuốc nghiên cứu hay gặp nhất là đau xương. Đau xương nhìn chung có độ nặng từ nhẹ đến trung bình, thoáng qua và có thể kiểm soát ở phần lớn các bệnh nhân với các thuốc giảm đau chuẩn.
Các rối loạn đường tiêu hóa: Buồn nôn được ghi nhận ở người tình nguyện khỏe mạnh thường xuyên hơn ở bệnh nhân dùng hóa trị.
Các tác dụng không mong muốn rất thường gặp (≥ 10%) và thường gặp (≥ 1%, < 10%) trong các nghiên cứu lâm sàng là:
| Hệ thống cơ thể | Các tác dụng không mong muốn | |
| Các rối loạn cơ xương và mô liên kết | Rất thường gặp | Đau xương |
| Thường gặp | Đau khớp, đau cơ, và đau lưng, chi, đau cơ-xương, và đau cổ | |
| Các rối loạn toàn thân và tại vị trí tiêm thuốc | Thường gặp | Đau tại vị trí tiêm và hồng ban, đau ngực (không phải tim), đau |
| Rối loạn hệ thần kinh trung ương | Thường gặp | Đau đầu |
Bất thường các thông số cận lâm sàng:
- Acid uric tăng nhẹ đến trung bình có thể hồi phục được, không gây hậu quả lâm sàng, rất thường gặp, tăng nhẹ đến trung bình alkaline phosphatase và lactate dehydrogenase, có thể hồi phục được, không gây hậu quả lâm sàng, rất thường gặp trên bệnh nhân dùng Pegfilgrastim sau khi hóa trị độc tế bào.
Sau khi lưu hành trên thị trường
Các rối loạn da và mô dưới da:
- Các phản ứng kiểu dị ứng, bao gồm phản vệ, mẩn ngứa ở da, mề đay, phù mạch, khó thở và giảm huyết áp, hồng ban và ngứa, xuất hiện khi mới điều trị hoặc lần điều trị sau đó đã được ghi nhận hiếm ở bệnh nhân dùng pegfilgrastim. Trong một số các trường hợp, các triệu chứng tái hiện với cùng mức độ, gợi ý một mối quan hệ nhân quả. Nếu xuất hiện phản ứng dị ứng nặng, nên có điều trị thích hợp, và phải theo dõi bệnh nhân chặt chẽ vài ngày. Cần ngưng vĩnh viễn điều trị pegfilgrastim ở những bệnh nhân có phản ứng dị ứng nặng.
Các rối loạn đường tiêu hóa:
- Đã ghi nhận rất hiếm các trường hợp bị vỡ lách trong quá trình điều trị với pegfilgrastim.
Các rối loạn ở da và mô dưới da:
- Các trường hợp hiếm gặp Hội chứng Sweet (viêm da sốt cấp tính) đã được báo cáo
- Phản ứng của viêm mao mạch da đã được báo cáo ở những bệnh nhân bị ung thư, đang dùng pegfilgrastim (tần suất báo cáo ước chừng: 0,00038%).
Thông báo cho bác sĩ những tác dụng không mong muốn gặp phải khi sử dụng thuốc.
Tương tác với các thuốc khác
- Do những tế bào dòng tủy đang phân chia nhanh nhạy cảm với hóa trị độc tế bào, nên dùng Pegfilgrastim khoảng 24 giờ sau khi truyền hóa trị độc tế bào. Trong các nghiên cứu lâm sàng, Pegfilgrastim đã được sử dụng an toàn 14 ngày trước khi hóa trị. Dùng đồng thời Pegfilgrastim với bất kỳ thuốc hóa trị nào chưa được đánh giá trên bệnh nhân. Trong những mẫu nghiên cứu trên động vật dùng đồng thời Pegfilgrastim và 5-fluorouracil (5-FU) hoặc các thuốc chống chuyển hóa khác cho thấy tăng khả năng ức chế tủy.
- Tăng hoạt động các yếu tố tạo máu của tủy xương trong việc đáp ứng với điều trị yếu tố tăng trưởng liên quan với các thay đổi dương tính về hình ảnh xương tạm thời. Việc này nên cân nhắc khi đọc kết quả hình ảnh xương.
- Những tương tác có thể xảy ra với các yếu tố tăng trưởng hệ tạo máu và với các cytokines vẫn chưa được nghiên cứu một cách cụ thể trong các nghiên cứu lâm sàng.
- Khả năng tương tác với lithium, mà thúc đẩy sự phóng thích bạch cầu đa nhân trung tính, chưa được nghiên cứu một cách cụ thể. Không có bằng chứng cho rằng tương tác như vậy sẽ có hại.
- Tính an toàn và hiệu quả của Pegfilgrastim chưa được đánh giá trên những bệnh nhân dùng hóa trị gây suy tủy muộn như chất nitrosoureas.
- Các nghiên cứu về chuyển hóa hoặc tương tác chuyên biệt chưa được tiến hành, tuy nhiên, các nghiên cứu lâm sàng không chỉ ra tương tác của Pegfilgrastim với bất kỳ sản phẩm thuốc nào.
Lưu ý khi sử dụng (Cảnh báo và thận trọng)
Cảnh báo chung:
- Dữ liệu lâm sàng hạn chế gợi ý rằng tác động lên thời gian phục hồi giảm bạch cầu đa nhân trung tính nặng giữa pegfilgrastim và filgrastim có thể so sánh được ở những bệnh nhân bị bạch cầu cấp dòng tủy tiên phát (xem phần Các nghiên cứu lâm sàng/hiệu quả). Tuy nhiên, tác động lâu dài của Pegfilgrastim ở những bệnh nhân bị bạch cầu cấp dòng tủy (AML) hiện vẫn chưa được thiết lập; do đó, nên dùng thuốc thận trọng ở những bệnh nhân này.
- Yếu tố kích thích tạo khúm bạch cầu hạt có thể thúc đẩy sự phát triển của các tế bào dòng tủy, bao gồm các tế bào ác tính, trên in vitro, và các tác dụng tương tự cũng có thể được quan sát in vitro trên một số tế bào không thuộc dòng tủy.
- Tính an toàn và hiệu quả của Pegfilgrastim chưa được nghiên cứu ở những bệnh nhân bị hội chứng loạn sản tủy, bạch cầu mạn dòng tủy và ở những bệnh nhân AML thứ phát; do đó, không nên dùng thuốc ở những bệnh nhân này. Cần đặc biệt thận trọng để chẩn đoán phân biệt sự chuyển dạng nguyên bào của bạch cầu mạn dòng tủy từ bạch cầu cấp dòng tủy.
- Tính an toàn và hiệu quả khi dùng Pegfilgrastim ở bệnh nhân AML tiên phát tuổi dưới 55 có đặc điểm di truyền học tế bào t(15;17) chưa được thiết lập.
- Tính an toàn và hiệu quả của Pegfilgrastim chưa được nghiên cứu trên những bệnh nhân dùng hóa trị liều cao.
- Sự xuất hiện các triệu chứng phổi như ho, sốt, và khó thở kết hợp với các triệu chứng X-quang thâm nhiễm phổi, và suy giảm chức năng phổi cùng với số lượng bạch cầu đa nhân trung tính tăng có thể là những dấu hiệu sơ khởi của Hội chứng Suy Hô hấp ở người lớn (ARDS). Trong những trường hợp như vậy, bác sĩ điều trị cân nhắc nên ngừng Pegfilgrastim và có điều trị thích hợp.
- Có rất ít các trường hợp vỡ lách, một số trường hợp bị tử vong, đã ghi nhận sau khi dùng pegfilgrastim. Nên theo dõi cẩn thận kích thước lách. Nên đánh giá phì đại lách hoặc sự vỡ lách ở những bệnh nhân đang dùng pegfilgrastim mà ghi nhận bị đau bụng trên bên trái hoặc đau mỏm vai trái.
- Điều trị với Pegfilgrastim đơn thuần không loại trừ giảm tiểu cầu và thiếu máu bởi vì hóa trị ức chế tủy vẫn được duy trì đầy đủ liều trong liệu trình đã kê toa. Khuyến cáo theo dõi thường xuyên số lượng tiểu cầu và chỉ số hematocrit.
- Không nên dùng Pegfilgrastim để tăng liều của hóa trị độc tế bào sau khi phác đồ liều lượng đã được xác lập.
- Đã có đợt kịch phát của bệnh hồng cầu liềm do sử dụng pegfilgrastim ở những bệnh nhân bị bệnh hồng cầu liềm. Các bác sĩ điều trị nên thận trọng khi cân nhắc việc dùng pegfilgrastim trên những bệnh nhân bị bệnh hồng cầu liềm, chỉ sử dụng thuốc sau khi đánh giá cẩn thận các nguy cơ tiềm tàng và lợi ích.
- Tính an toàn và hiệu quả của Pegfilgrastim trên những bệnh nhân có huy động các tế bào nguồn trong máu chưa được đánh giá một cách đầy đủ.
Các xét nghiệm:
- Số lượng bạch cầu 100 x 109/l hoặc nhiều hơn được ghi nhận dưới 1% số bệnh nhân dùng Pegfilgrastim. Không ghi nhận về bất cứ tác dụng ngoại ý nào liên quan trực tiếp tới mức độ tăng bạch cầu này. Sự tăng bạch cầu này là thoáng qua, điển hình thấy từ 24 tới 48 giờ sau khi tiêm thuốc và phù hợp với tác động dược lực học của Pegfilgrastim.
Sử dụng ở trẻ em:
- Chưa có đủ các dữ liệu về việc sử dụng Pegfilgrastim cho trẻ em và thanh thiếu niên dưới 18 tuổi.
Phụ nữ mang thai và cho con bú
Phụ nữ mang thai:
- Không có đầy đủ dữ liệu từ việc sử dụng pegfilgrastim ở những phụ nữ mang thai.
- Các nghiên cứu trên động vật đã cho thấy độc tính sinh sản (xem phần Khả năng sinh dị dạng thai). Nguy cơ tiềm ẩn cho phôi người hoặc thai chưa được biết.
- Không nên dùng Pegfilgrastim trong khi mang thai trừ khi thật cần thiết.
Phụ nữ cho con bú:
- Không có kinh nghiệm lâm sàng với phụ nữ cho con bú, vì thế không nên dùng Pegfilgrastim cho những phụ nữ đang cho con bú.
Người lái xe và vận hành máy móc
- Chưa có nghiên cứu nào được tiến hành về tác động của thuốc lên khả năng lái xe và vận hành máy móc.
- Cần thận trọng khi sử dụng cho các đối tượng lái xe và vận hành máy móc.
Bảo quản
- Bảo quản ở nhiệt độ 2-8oC (trong tủ lạnh).
Đánh Giá - Bình Luận
- Đặt đơn thuốc trong 30 phút. Gửi đơn
- Giao nhanh 2H nội thành HCM Chính sách giao hàng 2H.
- Mua 1 tặng 1 Đông Trùng Hạ Thảo Famitaa. Xem ngay
- Mua Combo giá tốt hơn. Ghé ngay
- Miễn phí giao hàng cho đơn hàng 700K
- Đổi trả trong 6 ngày. Chính sách đổi trả